Para esse equilíbrio:

1. Qual o pH de uma solução cuja concentração hidrogeniônica ([H+] é 10-8 ?
Resolução
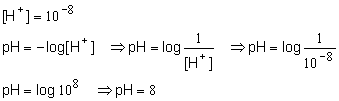
2. Determine o pH de uma solução 0,005M de ácido sulfúrico?
Resolução
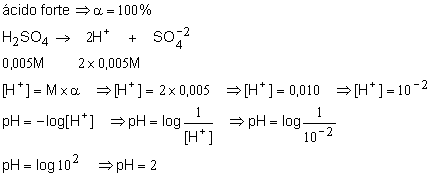
3. O volume do estômago de um adulto varia de 50 mL quando vazio a 1 L quando cheio.Considerando-se que o volume do estômago é 450 mL e que seu conteúdo é uma solução aquosa com pH igual a 2, calcule:
(Massas molares em g/mol: Na = 23,0; H = 1,00; C = 12,0; O = 16,0; Cl = 35,4.)
a) quantos mols de H+ estão contidos no estômago;
b) quantos gramas de hidrogenocarbonato de sódio serão necessários para neutralizar a acidez do estômago, supondo-se que todo H+ é proveniente do ácido clorídrico, um ácido forte.
b) quantos gramas de hidrogenocarbonato de sódio serão necessários para neutralizar a acidez do estômago, supondo-se que todo H+ é proveniente do ácido clorídrico, um ácido forte.
Resolução
A)
pH = -log[H+]
2 = -log[H+]
-2 = log[H+]
H+ = 10-2
H+ = 0,01 mols/L
0,01mols à 1 litro
x mols à 0,45 litro
x = 0,45 . 0,01
x = 0,0045 = 4,5.10-3
B)
NaHCO3 + HCl -> NaCl + CO2 + H2O
1 mol ______ 1mol
x ______ 4,5 ·10-3 mol
x = 4,5 ·10–3 mol NaHCO3
n = m/M -> 4,5 ·10-3 = m/84
m = 3,78.10-1g




Nenhum comentário:
Postar um comentário