Aula
1
1. Introdução Histórica
2. Classificação Periódica Moderna
Em
1914, o inglês Henry Gwin-Jeffreys Moseley faz algumas correções na tabela
proposta por Mendeleyev, pois, através da análise de espectros de raio-x de
diferentes metais, demonstra que a ordenação dos elementos na Tabela Periódica
deveria ser em função do número atômico e não da massa atômica dos elementos.
A
partir desse momento, é estabelecido um novo enunciado da Lei da Periodicidade
( Lei da Periodicidade de Moseley):
“Muitas
propriedades físicas e químicas dos elementos variam periodicamente em função
de seus números atômicos.”
Tabela Periódica atual é constituída por:
1º.
Sete Períodos (horizontais)

Observações:
No 6º
período, na 3ª “casinha”, existem 15 elementos
que constituem a série dos lantanídeos ou terras raras.
No
7º período, na 3ª “casinha”, existem 15
elementos que constituem a série dos
actinídeos.
2º. Dezoito Colunas ou
Grupos (verticais)
A partir de 1985, a União Internacional de Química Pura e
Aplicada (I.U.P.A.C.), passou a nomear as colunas da tabela periódica por
grupos e numerando-os de 1 a
18.

3º. Classificação dos Elementos Químicos
a)
Grupo A - Elementos Representativos: o último elétron encontra-se no
subnível “s” ou “p”.
Esses elementos são chamados
típicos, representativos ou característicos da Tabela Periódica e apresentam
grande semelhança nas propriedades químicas, dentro de um mesmo grupo, por
apresentarem o mesmo número de elétrons na camada de valência. São
representativos os grupos: IA, IIA, IIIA até VIIA ou 1,2, 13 até 17.
Exemplos:
11Na 1s2 2s2
2p6 3s1 à último elétron no
subnível “s”
15P 1s2 2s2
2p6 3s2 3p3 à último elétron no
subnível “p”
b) Grupo B - Elementos de Transição: o
último elétron encontra-se no subnível “d”.
Os elementos dos subgrupos B ou grupos 3 ao 12
são chamados elementos de transição.
Exemplo:
21Sc 1s2 2s2 2p6 3s2 3p6 4s2 3d1 à último elétron no
subnível “d”
c) Grupo dos Elementos de Transição Interna:
o último elétron encontra-se no subnível “f”.
Exemplo:
58Ce 1s2 2s2 2p6 3s2 3p6
4s2 3d10 4p6
5s2 4d10 5p6 6s2 4f2 à último elétron no
subnível “f”
Esses
elementos dividem-se em duas séries:
-
Série dos Lantanídeos ou metais terras raras: são os elementos de
número atômico 57 (lantânio) até 71 (lutécio). Localizam-se no subgrupo 3B (3)
e no 6º. período.
-
Série dos Actinídeos: são os elementos de número atômico 89 (actínio)
até 103 (laurêncio). Localizam-se no subgrupo 3B (3) e no 7º. período.
d) Grupo 0 - Gases
Nobres, Raros ou Inertes: com exceção do hélio
que apresenta dois elétrons na camada K (1),
todos esses elementos apresentam oito elétrons na camada de valência. Ocupam o
grupo O, 8A ou 18.
Exemplo:
10Ne 1s2 2s2 2p6 à 8 elétrons na camada de
valência
18Ar 1s2 2s2 2p6 3s2
3p6 à 8 elétrons na camada de valência
Exercício
resolvido:
Observe a tabela abaixo e
responda aos itens a seguir:
a)
Qual(ais) as letras correspondem a elementos representativos?
b) Qual(ais)
as letras correspondem a elementos de transição?
c) Qual(ais)
as letras correspondem a elementos de transição interna?
d)
Qual(ais) as letras que indicam gases nobres?
Resolução:
a) Os elementos representativos
estão nos grupos 1 (IA), 2(IIA), 3(IIIA) até 17(VIIA): A, C, D E, F e I.
b) Os elementos representativos de
transição estão nos grupos 3 (IIIB) até 12 (2B): G e L.
c) Os elementos representativos de
transição interna estão no grupos3 (IIIB) nas séries dos lantanídeos e
actinídeos: H e K.
d) Os gases nobres estão no grupo 18
(0 ou 8ª): B e J.
4º. Metais, semi-metais, não-metais e gases nobres
.jpg)
Importante: o
hidrogênio pode ser colocado na Tabela Periódica
• na família dos metais
alcalinos (IA), apesar de não ser um metal alcalino, mas por possuir um elétron
na camada de valência, como todos os elementos desta família;
• na família dos halogênios
(VIIA), pois é um gás à temperatura ambiente, como o flúor (F2) e o cloro
(Cl2) e
forma moléculas diatômicas como todos os elementos desta família;
• ou ainda, ser colocado fora da
Tabela Periódica, por não possuir todas as propriedades de nenhuma família.
Aula
2
Características
Eletrônicas dos Elementos
Quando analisamos um período da Tabela Periódica,
podemos perceber que, ao passarmos de um elemento a outro, o número atômico
aumenta de uma unidade, assim ele tem um próton a mais no núcleo e um elétron a
mais na eletrosfera. Esse novo elétron
é chamado elétron de diferenciação.
Usando essa
idéia podemos localizar cada elemento químico na Tabela Periódica.
1º. Como
localizamos o período de um átomo?
O
número de níveis de energia que o
átomo do elemento apresenta em sua configuração eletrônica indicará sempre o período
ao qual esse elemento pertence na Tabela Periódica.
Exemplos:
Exercício
resolvido:
Em
que período está cada um dos elementos abaixo?
a) 15P 1s2 2s2 2p6
3s2 3p3
à 3 camadas eletrônicas = 3º. Período
b) 23V 1s2 2s2 2p6
3s2 3p63d3
4s2 à
4 camadas
eletrônicas = 4º. Período
2º. Como
localizamos o grupo de um átomo?
a) Elementos Representativos - Subgrupos A ou Grupos 1, 2 e 13 até 17.
O
número do subgrupo é dado pelo
número de elétrons existentes na camada de valência.
Exemplos:
Determine o grupo de
cada elemento abaixo.
a) Na (Z
= 11)
11Na 1s2 2s2 2p6 3s1
Portanto,
esse elemento é do subgrupo IA ou grupo 1 (metais alcalinos).
b) Mg (Z
= 12)
12Mg 1s2 2s2 2p6 3s2
Portanto, esse elemento é do subgrupo IIA ou grupo 2 (metais
alcalino-terrosos).
c) S (Z
= 16)
16S
1s2 2s2
2p6 3s2 3p4 à
6 elétrons na camada de valência
Portanto, esse elemento é do subgrupo VIA
ou grupo 16 (10 + 6 = 16) – grupo dos calcogênios.
d) Cl (Z
= 17)
17Cl 1s2 2s2 2p6 3s2 3p5 à 7 elétrons na camada de valência
Portanto, esse elemento é do subgrupo VIIA
ou grupo 17 (10 + 7 = 17) – grupo dos halogênios.
c) Gases Nobres - Elementos do Grupo 0, 18 ou VIII
A
Caracterizam-se
por apresentar 8 elétrons na camada de valência e o elétron de diferenciação se
localiza no subnível p da camada de valência.
Exceção: o átomo de
Hélio, He, tem apenas dois elétrons na camada K.
Exemplo:
10Ne 1s2 2s2 2p6 à 8 elétrons na camada
de valência, portanto, esse elemento é do grupo VIIIA ou 18.
Exercício
resolvido:
Determine o grupo do argônio, Ar (Z
= 18):
18Ar 1s2 2s2 2p6 3s2 3p6 à 8 elétrons na camada de valência
Portanto, esse elemento é do grupo VIIIA ou
grupo 18 (10 + 8 = 18) – grupo dos gases nobres.
Importante: seguindo
a nova recomendação da IUPAC, devemos somar o número 10 ao número de elétrons
da
camada
de valência dos subgrupos IIIA até VIIIA para achar o número do grupo.
Aula
3
Como localizamos o grupo
de um átomo? (continuação)
1º.) Elementos de Transição - Grupos B (ou 3 a 12)
O número do subgrupo será dada pelo número de elétrons dos dois subníveis
mais energéticos:
nsX
(n-1)dy à x + y = número do
subgrupo
Subníveis mais energéticos
|
Soma
x + y
|
Número
do subgrupo
|
s2d1
|
3
|
3 ou 3B
|
s2d2
|
4
|
4 ou 4B
|
s2d3
|
5
|
5 ou 5B
|
s2d4
|
6
|
6 ou 6B
|
s2d5
|
7
|
7 ou 7B
|
s2d6
|
8
|
8 ou 8B
|
s2d7
|
9
|
9 ou 8B
|
s2d8
|
10
|
10 ou 8B
|
s2d9
|
11
|
11 ou 1B
|
s2d10
|
12
|
12 ou 2B
|
Observação: o subgrupo 8B tem três colunas
Exemplos:
1)
Cu (Z =
29)
29Cu 1s2
2s2 2p6 3s2 3p6 4s1 3d10
à subníveis mais
energéticos
Portanto, esse elemento é do grupo IB ou 11 (1 + 10)
2)
Sc (Z =
21)
21Sc 1s2
2s2 2p6 3s2 3p6 4s2 3d1
à subníveis mais
energéticos
Portanto
esse elemento é do grupo IIIB ou 3 (2+1).
3)
Co (Z =
27)
27Co 1s2
2s2 2p6 3s2 3p6 4s2 3d7
à subníveis mais
energéticos
Portanto é do grupo 9 (2+7). Pela
numeração antiga: 2 + 7 = 9, portanto é da 2ª coluna do grupo VIIIB.
2º.) Elementos de Transição Interna
(lantanídeos e actinídeos)
Apresentam 2 elétrons na camada de valência, na
penúltima camada apresentam 8 ou 9 elétrons e na antepenúltima apresentam 18 < x < 32 elétrons; sendo assim, o elétron de diferenciação se
localiza no subnível f da antepenúltima camada. Todos esses elementos se
localizam no grupo IIIB ou 3.
Aula
4
1 – Os
Elementos Químicos São Divididos em Blocos
Para
esta divisão, devemos verificar em que subnível se localiza o elétron de
diferenciação:

2 – Propriedades Aperiódicas e Periódicas
1º.) Propriedade Aperiódicas
São aquelas que jamais se
repetem a um certo intervalo, isto é, sempre crescem ou decrescem com o aumento
do número atômico (z).
Exemplo:

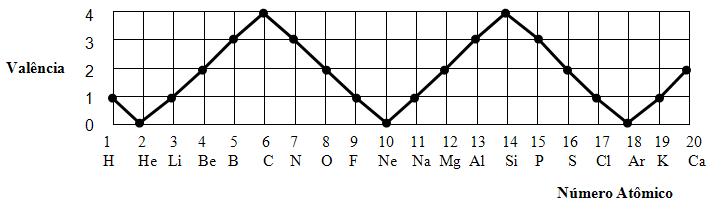
2º.) Propriedade Periódicas
São aquelas que jamais se
repetem a um certo intervalo, isto é, sempre crescem ou decrescem com o aumento
do número atômico (z).
Exemplo:





Nenhum comentário:
Postar um comentário